Metan (công thức hóa học ch4) là thành phần chính của khí chúng ta sử dụng. Vậy khí metan là gì? Hãy cùng chúng tôi tìm hiểu trạng thái tự nhiên, tính chất, ứng dụng và phương pháp điều chế khí metan trong bài viết dưới đây.
Mêtan là gì?
Mêtan là một chất khí không màu, không mùi và không vị, nhẹ hơn không khí. Trong tự nhiên, mêtan có nhiều trong các mỏ khí (khí tự nhiên), mỏ dầu (khí mỏ dầu hoặc khí đồng hành), mỏ than (khí mỏ than), bùn ao (khí bùn ao), khí sinh học …
-
Công thức phân tử: ch4
-
Metan (ch4) có khối lượng phân tử là 16 đvC.
-
Cấu trúc phân tử:
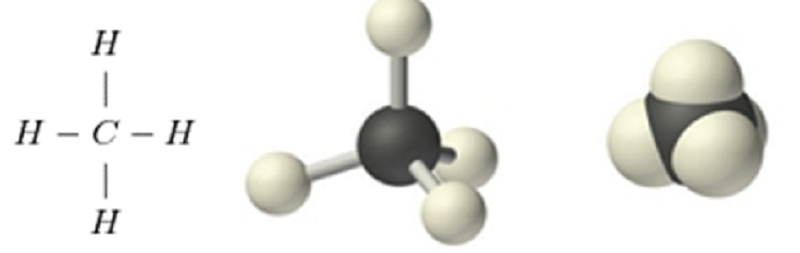
Metan chỉ có 4 liên kết đơn.
Các hydrocacbon mạch hở, chẳng hạn như metan, chỉ có một liên kết đơn được gọi là ankan, với công thức chung là cnh2n + 2, n≥1
Tính chất vật lý của mêtan
Metan (ch4) có các tính chất vật lý sau:
-
Mêtan là một chất khí không màu, không mùi, không vị, ít tan trong nước.
-
Tỉ khối của metan đối với không khí là dch4 / kk = 16/29.
-
Đây là một loại khí rất độc, dễ cháy tạo ra ngọn lửa màu xanh lam.
-
ch4 hóa lỏng ở -162 ° c và đông đặc ở -183 ° c.
-
Điểm chớp cháy: 537 ° c.
-
Mật độ mêtan: 0,717 kg / m3
-
Metan không tan trong dung môi phân cực vì các hydro không có liên kết, chúng chỉ tan trong dung môi không phân cực.
-
ch4 không dẫn điện.
Tính chất hóa học của mêtan
Trên thực tế, khí mêtan có nhiều tính chất hóa học khác nhau. Tuy nhiên, metan sở hữu hai tính chất cơ bản và tiêu biểu nhất, đó là khả năng phản ứng với oxy và clo trong các điều kiện phản ứng khác nhau. p>
Phản ứng với oxy
Thí nghiệm: Đốt cháy khí mê-tan với ôxy
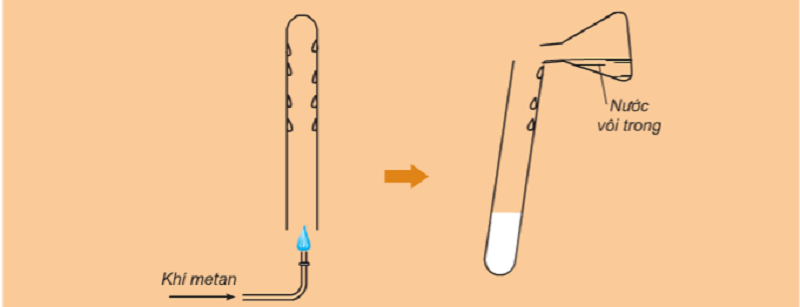
Hiện tượng:
-
Sau khi đốt, trên thành ống nghiệm có những giọt nước nhỏ.
-
Đổ dung dịch nước vôi trong vào ống nghiệm sau khi nung, dung dịch có màu trắng đục.
-
Ống nghiệm đang nóng dần lên.
Kết luận:
-
Mêtan cháy tạo thành khí cacbonic và hơi nước.
-
Phản ứng tỏa nhiệt.
-
Phương trình hóa học: ch4 (k) + 2o2 (k) → co2 (k) + 2h2o (h) (điều kiện nhiệt độ)
Lưu ý: Một hỗn hợp gồm một thể tích metan và hai thể tích ôxy là một hỗn hợp rất dễ nổ.

Tương tác với clo
Thí nghiệm: Cho hỗn hợp metan và clo phản ứng với nhau trong bình kín ở điều kiện có ánh sáng.
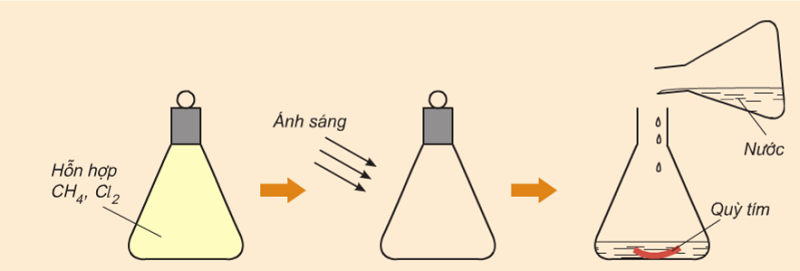
Hiện tượng:
-
Ban đầu hỗn hợp khí có màu vàng, có clo trong đó. Sau một thời gian, màu vàng nhạt dần và mất dần.
-
Thêm nước, sau đó nhúng giấy quỳ vào bình thì thấy giấy quỳ chuyển sang màu đỏ.
Kết luận:
-
Metan phản ứng với clo dưới ánh sáng, và sản phẩm tạo thành có tính axit, vì vậy nó chuyển sang màu đỏ khi cho giấy quỳ xanh ướt vào.
-
Phương trình hóa học: ch4 + cl2 → hcl + ch3cl (clorometan)
-
Trong phản ứng này, nguyên tử hydro của metan được thay thế bằng nguyên tử clo, vì vậy nó được gọi là phản ứng thế. Nếu dùng khí clo dư thì tất cả các nguyên tử hiđro có trong phân tử metan đều có thể bị thay thế bằng nguyên tử clo.
Làm thế nào để điều chế khí metan?
Có nhiều cách để tạo ra khí mêtan, nhưng khí được sản xuất và sử dụng phổ biến nhất trong hai môi trường phổ biến: phòng thí nghiệm và công nghiệp.
Điều chế mêtan trong phòng thí nghiệm
Một số phương pháp phổ biến để chuẩn bị trong phòng thí nghiệm cho ch4 như sau:
Khi cần một lượng nhỏ metan, natri axetat được đun nóng với xút hoặc được điều chế bằng phản ứng của nhôm cacbua với nước.
- Điều chế ch4 từ nhôm cacbua:
- Natri axetat phản ứng với xút tạo thành khí mêtan (nhiệt phân natri cacboxylat):
- Cách sản xuất metanol bằng cách hiđro hoá cacbon:
- Cách điều chế ch4 từ co gas:
- Hợp chất hữu cơ là gì? Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- Hiểu silica là gì? Các ứng dụng trong ngành công nghiệp silicat là gì?
-
Khí mê-tan Nhiên liệu Đối với lò nướng , gia đình hoặc máy nước nóng, lò nung … có cơ chế đốt cháy oxy sinh nhiệt.
-
Mêtan đóng một vai trò quan trọng trong việc tạo ra điện khi nó được đốt cháy làm nhiên liệu trong các tuabin khí. Trong các nhà máy nhiệt điện, mêtan được sử dụng làm nhiên liệu cùng với than để tạo ra hiệu suất tốt và giảm nguy cơ ô nhiễm môi trường.
-
Do hàm lượng mêtan trong khí mỏ có thể lên tới 98% nên nó có thể được sử dụng làm nhiên liệu cho động cơ ô tô.
Tuy nhiên, CBM và các nhiên liệu khí khác có mức năng lượng thể tích thấp hơn. Trong trường hợp bình thường, nhiệt đốt cháy của 1 lít CBM là khoảng 33-36 kj. Đồng thời, nhiệt lượng tỏa ra khi đốt cháy 1 lít xăng là 31.400 kJ, gấp 1.000 lần khí mêtan trong than đá. Kết quả là, các nhà nghiên cứu có thể xác nhận rằng CBM có thể được sử dụng ở dạng nén hoặc hóa lỏng để làm nhiên liệu cho động cơ ô tô.
Phân tích các nghiên cứu về độc tính trên các phương tiện chạy bằng khí đốt đã cho kết quả tốt khi thay thế nhiên liệu xăng bằng khí metan. Thành phần (tính bằng g / km) của các khí độc thải ra môi trường bị giảm đi nhiều lần: cacbon oxit 5-10 lần, hydrocacbon – 3 lần, nhóm khí nitơ oxit – 1,5-2,5 lần …
-
Ngoài ra, ở nhiều nơi, mêtan còn được gọi là “khí thiên nhiên” – nó được lắp đặt trong hệ thống đường ống dẫn đến từng ngôi nhà và được sử dụng để sưởi ấm và nấu ăn.
Ứng dụng công nghiệp
Khí mêtan hiện được sử dụng trong các phản ứng hóa học công nghiệp khác nhau và được vận chuyển an toàn dưới dạng khí hóa lỏng.
-
Trong hóa học công nghiệp, metan là nguyên liệu chính để sản xuất hydro, metanol, axit axetic và anhydrit axetic.
-
Metan là nguyên liệu thô để điều chế h2, theo phương trình:
ch4 + h2o (t °, xt) → co2 + h2
-
Mêtan là nguyên liệu chính để sản xuất than nghiền thành bột và nhiều hóa chất khác như metanol, anhydrit axetic hoặc axit axetic …
Bài tập về Metan – Sách giáo khoa Hóa học 9 & Dung dịch
Dựa vào kiến thức trên, các em có thể vận dụng kiến thức này để giải một số bài tập sau.

Giải bài 2 SGK Hóa 9 trang 116
Phương trình hóa học nào sau đây đúng? Phương trình hóa học nào sai?
a) ch4 + cl2 → ch2cl2 + h2 (ánh sáng)
b) ch4 + cl2 → ch2 + 2hcl (nhẹ)
c) 2ch4 + cl2 → 2ch3cl + h2 (ánh sáng)
d) ch4 + cl2 → ch3cl + hcl (nhẹ)
Câu trả lời được đề xuất:
Phương trình hóa học đúng là trường hợp d. Các trường hợp còn lại đều sai.
Giải bài 3 SGK Sinh 9 trang 116
Đốt cháy hoàn toàn 11,2 lít khí metan (đktc). Tính lượng khí oxi cần dùng và khối lượng khí cacbonic tạo thành. Biết các thể tích khí đo ở ptc.
Câu trả lời được đề xuất:
nch4 = 11,2 / 22,4 = 0,5 mol
Phương trình phản ứng:
ch4 + 2o2 → co2 + 2h2o
Theo phương trình: no2 = 2 x nch4 = 2 x 0,5 = 1 mol.
nco2 = nch4 = 0,5 mol.
vo2 = 1 x 22,4 = 22,4 lít.
vco2 = 0,5 x 22,4 = 11,2 lít.
Giải bài 4 Trang 116 SGK ngữ văn 9
Có một hỗn hợp của khí cacbonic và mêtan. Đưa ra phương pháp hóa học:
a) Nhận khí ch4
b) Thu được khí cacbonic.
Câu trả lời được đề xuất:
Phương pháp hóa học:
a) Thu được khí ch4:
Cho hỗn hợp khí đi qua một lượng dư dung dịch ca (ồ) 2, khí co2 bị thu vào phản ứng tạo ra caco3 và khí đi ra khỏi dung dịch là ch4 có lẫn hơi nước nên cần đã sấy khô và sấy cao để thu được ch4 tinh khiết. Chúng tôi có pthh sau:
co2 + ca (oh) 2 → caco3 ↓ + h2o.
b) Caco3 thu được ở trên cho phản ứng với dung dịch HCl loãng ta thu được khí CO2. Làm lạnh nước ngưng sẽ thu được co2 tinh khiết / ta có pthh sau:
caco3 + 2hcl → cacl2 + co2 ↑ + h2o
Bài viết trên cung cấp đầy đủ thông tin về metan và khái niệm, trạng thái, tính chất, điều chế, ứng dụng của loại khí này trong đời sống. Hy vọng những thông tin này sẽ giúp bạn có thêm nhiều kiến thức bổ ích và áp dụng chúng trong học tập và thực hành của mình.
-
-
-
-
al4c3 + 12h2o → 4al (oh) 3 + 3ch4
ch3-coona + nah → (nhiệt độ cao, nhiệt độ) na2co3 + ch4
c + 2h2 → (nhiệt độ, ni) ch4
co + 3h2 → (nhiệt độ) h2o + ch4
Hoặc bằng cách khử các dẫn xuất halogen, rượu hoặc metyl của cacbonyl để điều chế ch4.
Sản xuất khí mêtan trong công nghiệp
Trong công nghiệp, mêtan và các đồng loại của nó được tách ra khỏi khí tự nhiên và dầu mỏ . Đây là cách dễ nhất và nhanh nhất để điều chế ch4.
Xem thêm:
Ứng dụng của mêtan
Metan là một trong những nguyên liệu không thể thiếu và quan trọng trong sản xuất công nghiệp và sinh hoạt của con người.

Ứng dụng trong nhiên liệu
Khí mê-tan đã trở thành một loại nhiên liệu quan trọng được lựa chọn để sản xuất điện, sưởi ấm hoặc làm nhiên liệu cho động cơ xe hơi do khả năng sinh nhiệt cao của nó.

-
-
-
-
-
-



