Một tìm kiếm trên google cho từ khóa “lưu huỳnh có hại” đã thu được 4.610.000 kết quả trong 0,35 giây. Vậy lưu huỳnh là gì, có độc hay không? Hãy cùng tìm hiểu những tính chất và ứng dụng chung nhất của chất phổ biến này.

Lưu huỳnh là gì?
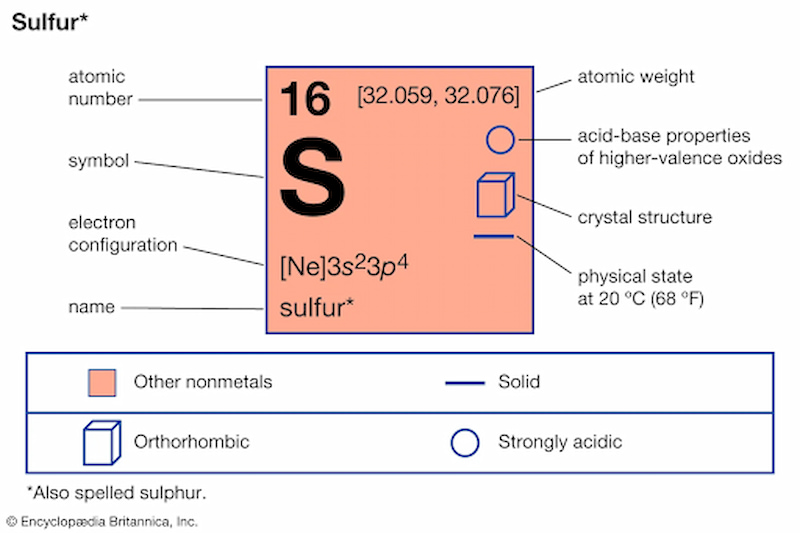
Lưu huỳnh (còn được gọi là lưu huỳnh, lưu huỳnh hoặc lưu huỳnh) là một nguyên tố hóa học trong bảng tuần hoàn với ký hiệu s và số nguyên tử 16. Lưu huỳnh là một phi kim loại phổ biến. Không mùi, không vị, đa hóa trị. Dạng mẹ của lưu huỳnh là chất rắn kết tinh màu vàng chanh, được coi là nguyên tố cần thiết cho sự sống, và có trong hai axit amin.
Lưu huỳnh ở đâu?
-
Trong tự nhiên, lưu huỳnh có thể tồn tại dưới dạng một nguyên tố đơn lẻ trong các khoáng chất sunfua và sunfat.
-
Lưu huỳnh nguyên tố được tìm thấy xung quanh các suối nước nóng và các khu vực núi lửa ở nhiều nơi trên thế giới, đặc biệt là dọc theo Vành đai lửa Thái Bình Dương.
Số nguyên tử: 16
Vị trí : thuộc họ lỗ thông, chu kỳ thứ ba của bảng tuần hoàn các nguyên tố hóa học.
Cấu hình e : 1s22s22p63s23p4, ngoài cùng là 6 lớp.
Tính chất vật lý của lưu huỳnh
Lưu huỳnh có các tính chất vật lý sau:

-
Trạng thái : Ở nhiệt độ phòng, lưu huỳnh là chất rắn xốp màu vàng nhạt. Lưu huỳnh ở trạng thái này thường tồn tại ở dạng phân tử vòng s8. Ngoài ra, nó có nhiều hình dạng khác. Loại bỏ một nguyên tử khỏi vòng sẽ là s7, đây là nguyên nhân gây ra màu vàng đặc trưng của nó. Ngoài ra, lưu huỳnh còn tồn tại ở dạng vô định hình hay còn gọi là lưu huỳnh dẻo.
-
Tinh thể : Lưu huỳnh có các tinh thể rất phức tạp, tùy thuộc vào các điều kiện khác nhau. Hình thái của chúng tạo nên các cấu trúc tinh thể khác nhau, trong đó hình thoi và đơn tà s8 có lẽ được nghiên cứu chặt chẽ nhất.
-
Mùi : Lưu huỳnh không phải là lựa chọn đầu tiên vì mùi của nó rất giống mùi trứng thối – một đặc trưng của hydro sunfua (h2s). Lưu huỳnh nguyên chất không có mùi. Khi cháy, nó tạo ra ngọn lửa màu xanh lam và phát ra khí sunfurơ – một thứ mùi ngột ngạt bất thường.
-
Tính hòa tan : Lưu huỳnh không hòa tan trong nước, nhưng hòa tan trong các dung môi không phân cực như carbon disulfide.
-
Mức độ oxi hóa: Lưu huỳnh có các trạng thái oxi hóa: -2, -1 (pyrit …), +2, +4, +6. Lưu huỳnh tạo thành các hợp chất bền với hầu hết các nguyên tố, ngoại trừ khí trơ.
-
Nóng chảy : Lưu huỳnh trong quá trình nấu chảy có xu hướng nhớt, đây cũng là một đặc điểm nổi bật của phi kim loại này. Độ nhớt của lưu huỳnh tăng theo nhiệt độ do sự hình thành các chuỗi polyme. Tuy nhiên, sau khi đạt đến một khoảng nhiệt độ nhất định, độ nhớt lại giảm do cần đủ năng lượng để phá vỡ các chuỗi polyme.
Hình dạng của lưu huỳnh
Lưu huỳnh có hai dạng thù hình, lưu huỳnh hai pha sα và lưu huỳnh đơn tà sβ. Hai dạng thù hình khác nhau về cấu trúc tinh thể và một số tính chất vật lý, nhưng có tính chất hóa học tương tự nhau. Hai dạng lưu huỳnh, sα và sβ, có thể chuyển hóa lẫn nhau tùy thuộc vào điều kiện nhiệt độ. Vui lòng theo dõi bảng dưới đây để tìm hiểu thêm về sự tương hỗ này:
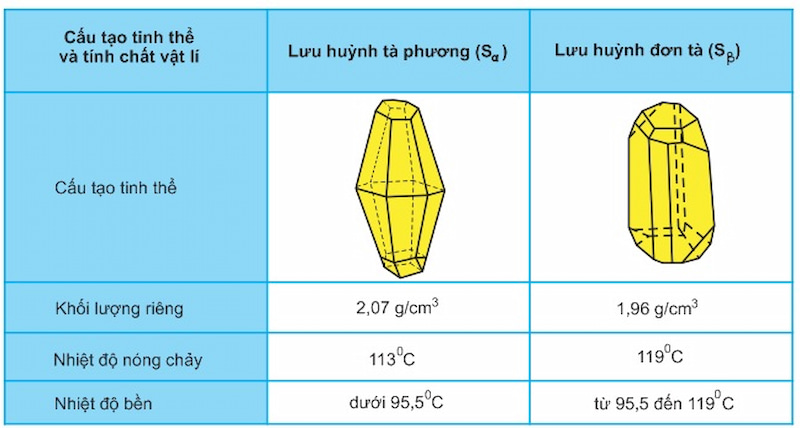
Ảnh hưởng của nhiệt độ đến tính chất vật lý của lưu huỳnh
Các tính chất vật lý của lưu huỳnh thay đổi đáng kể theo nhiệt độ. Đó là:
-
Ở nhiệt độ dưới 113 độ: cả sα và sβ đều là chất rắn màu vàng. Có 8 nguyên tử trong phân tử liên kết cộng hóa trị với nhau tạo thành vòng.
-
Ở 119 độ: sα và sβ tan chảy thành một chất lỏng rất lỏng màu vàng.
-
Ở 187 độ: Lưu huỳnh lỏng sền sệt và có màu nâu đỏ.
-
Ở nhiệt độ 445 độ: lưu huỳnh sôi và các phân tử lưu huỳnh bị phân hủy thành nhiều phân tử nhỏ dễ bay hơi.
Ví dụ: Ở 1400 độ C, hơi lưu huỳnh là phân tử s2. Nhưng ở 1700 độ C, lưu huỳnh là s.
Tính chất hóa học của lưu huỳnh
Điểm nổi bật của hóa học hình thoi là nó thể hiện cả tính chất oxy hóa ở các trạng thái oxy hóa khác nhau, bao gồm: -2, 0, +4, +6, cũng như tính chất khử. Hãy cùng tìm hiểu chi tiết tính chất này trong các thí nghiệm với lưu huỳnh kim loại, hiđro và phi kim.

Phản ứng với kim loại và hydro
Ở nhiệt độ cao, lưu huỳnh phản ứng với hiđro tạo thành khí hiđro sunfua, khí này phản ứng với kim loại tạo thành muối sunfua.
Tương tác với hydro
Khi cho hiđro đi qua ống nghiệm đựng lưu huỳnh đang sôi thì lưu huỳnh phản ứng trực tiếp với hiđro. Thực nghiệm quan sát, thấy có khí mùi trứng thối, đó là khí hiđro sunfua.
Phương trình phản ứng: h2 + s → h2s (điều kiện nhiệt độ: 350 độ)
Hiệu ứng kim loại
Phản ứng với kim loại là một trong những tính chất hóa học đặc trưng của lưu huỳnh. Khi đun nóng, lưu huỳnh có thể phản ứng với nhiều kim loại tạo thành nhiều hợp chất khác nhau.
Ví dụ:
-
Trong khi trộn bột sắt và lưu huỳnh, hãy đun nhẹ. Nhìn vào phản ứng, ta thấy phản ứng tỏa nhiệt và xảy ra mạnh hơn theo phương trình: fe + s → fes (điều kiện nhiệt độ)
-
Lưu huỳnh phản ứng mạnh với kẽm và nhôm khi bay hơi nhanh. Dây đồng mỏng cháy trong lưu huỳnh tạo ra chất nhờn màu đen.
Điều đáng chú ý là ở nhiệt độ phòng, phương trình phản ứng của thủy ngân và lưu huỳnh là: hg + s → hgs. Trong phản ứng này, s có tính oxi hóa, nó oxi hóa fe (0), hg (0) thành fe (+2) và hg (+02), và h (0) thành h (1).
Hiệu ứng phi kim loại
Ở nhiệt độ phòng, lưu huỳnh phản ứng mạnh hơn với hầu hết các nguyên tố phi kim loại, chẳng hạn như flo, oxi, clo … trừ iot và nitơ. Khi lưu huỳnh cháy trong không khí, lưu huỳnh (iv) oxit phát ra ngọn lửa màu xanh lam.
s + o2 → so2 (nhiệt độ)
s + 3f2 → sf6 (nhiệt độ)
Trong các phản ứng này, lưu huỳnh thể hiện tính khử của nó bằng cách khử o (0) thành o (-2) và f (0) thành f (-1).
Lưu huỳnh được điều chế như thế nào?
Trong phần này, chúng ta sẽ tìm hiểu hai phương pháp điều chế lưu huỳnh bằng hai phương pháp phổ biến hiện nay: trong phòng thí nghiệm và trong công nghiệp.
Trong phòng thí nghiệm
Trong phòng thí nghiệm, lưu huỳnh được điều chế bằng cách cho muối sunfua (muối của axit yếu) phản ứng với axit mạnh hơn (thường là dung dịch của axit sunfuric và natri sunfit) theo quy trình sau:
p>
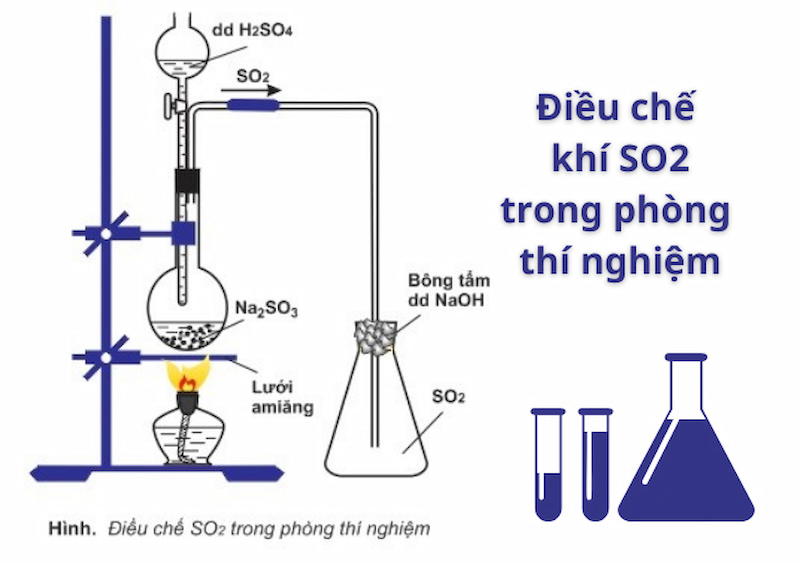
-
Đổ từ từ dung dịch axit sunfuric vào bình cùng với natri sunfit, sau đó đậy nắp lại theo phương trình: h2so4 + na2so3 → na2so4 + so2 + h2o (điều kiện: đun nóng). Chú ý rằng bình khí dựng thẳng đứng vì so2 nặng hơn không khí.
-
Đun nóng bình bằng ngọn lửa đèn cồn và sử dụng lưới amiăng. Mục đích của tấm lưới này là ngăn ngọn lửa tập trung vào một chỗ, có thể làm vỡ bình khi đun nóng dung dịch
-
Khí lưu huỳnh đioxit được thu thập bằng cách truyền không khí. Người ta dùng bông tẩm dung dịch natri hiđroxit (naoh) để hạn chế lượng khí lưu huỳnh đioxit thoát ra.
Lưu ý:
-
Không dùng bông tẩm khí amoniac (nh3), vì đây là khí dễ bay hơi và sẽ làm cho việc thu khí không hiệu quả.
-
Sulfite phản ứng với axit clohydric để tránh axit bay hơi trộn thành so2, điều này sẽ ảnh hưởng đến kết quả chính xác.
Ngành
Trong công nghiệp, có một số cách để điều chế lưu huỳnh:
-
Đốt lưu huỳnh: s + o2 (nhiệt độ) → so2
-
Đốt cháy h2s trong oxy dư: 2h2s + 3o2 → 2h2o + 2so2
-
Các kim loại phản ứng với h2so4 (làm đặc do nhiệt):
cu + 2h2so4 → cuso4 + so2 + 2h2o
-
Pyrit sắt lửa (fes2): 4fes2 + 11o2 → 2fe2o3 + 8so2
Ứng dụng quan trọng của lưu huỳnh trong công nghiệp và đời sống
Lưu huỳnh là một trong những nguyên tố gắn liền với nhiều lĩnh vực của đời sống thực tế và đóng vai trò quan trọng trong nền kinh tế thế giới.
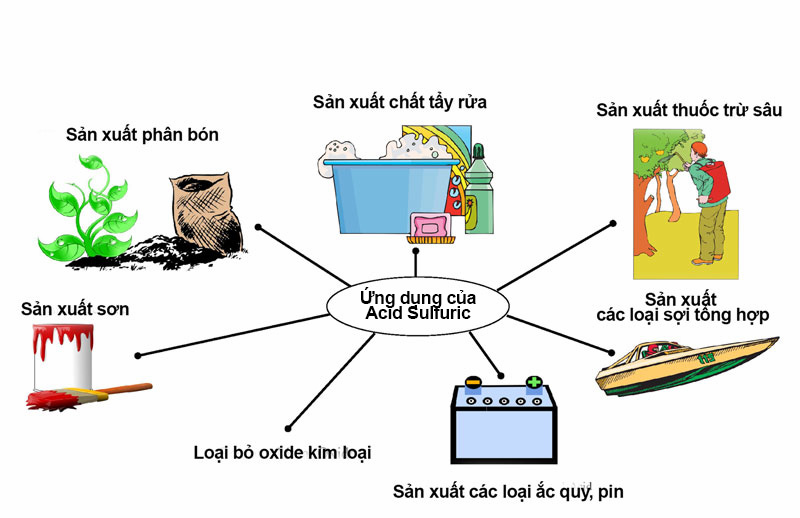
Ứng dụng của lưu huỳnh trong công nghiệp
Trong công nghiệp, 90% lưu huỳnh được chiết xuất thông qua dẫn xuất chính của nó, axit sulfuric (h2so4), được coi là một trong những nguyên tố quan trọng nhất được sử dụng làm nguyên liệu công nghiệp. Mức tiêu thụ axit sulfuric cũng được coi là một trong những chỉ số tốt nhất về sự phát triển công nghiệp của một quốc gia. Hoa Kỳ sản xuất nhiều lưu huỳnh mỗi năm hơn bất kỳ loại hóa chất công nghiệp nào khác.

Lưu huỳnh được sử dụng trong nhiều sản phẩm công nghiệp như: pin, chất tẩy giặt, cao su lưu hóa, chất diệt khuẩn và phân bón phốt phát. Cụ thể, lưu huỳnh được sử dụng để làm trắng giấy, làm chất bảo quản trong rượu và làm khô trái cây. Do tính dễ cháy, lưu huỳnh cũng được sử dụng trong sản xuất diêm, thuốc súng, thuốc nổ và pháo hoa …
Ứng dụng của lưu huỳnh trong làm đẹp
Việc sử dụng lưu huỳnh trong việc làm đẹp da và trị mụn đã được biết đến từ thời cổ đại. Tuy nhiên, không có nghiên cứu chắc chắn về cách thức hoạt động của nguyên tố này trong điều trị mụn trứng cá.
Qua các thí nghiệm, người ta kết luận rằng lưu huỳnh có đặc tính kháng viêm và kháng khuẩn mạnh, từ đó có khả năng thu nhỏ các nốt mụn nhanh chóng.

Ứng dụng của lưu huỳnh trong nông nghiệp
Ngoài những ứng dụng quan trọng nhất trong công nghiệp, trong nông nghiệp, lưu huỳnh còn được coi là một trong những nguyên liệu để sản xuất phân bón, thuốc trừ sâu, diệt nấm …
Ứng dụng của lưu huỳnh trong y học
Lưu huỳnh cũng đã cho thấy công dụng của nó trong y học. Magnesium sulfate được sử dụng như một loại thuốc nhuận tràng và có đặc tính kháng viêm, kháng khuẩn cao để điều trị các bệnh liên quan đến bệnh ngoài da.
Ví dụ: kem, kem dưỡng da, thuốc mỡ hoặc xà phòng lưu huỳnh trị mụn trứng cá, thuốc mỡ lưu huỳnh trị viêm da tiết bã, ghẻ …
Xem thêm:
- Nhóm halogen là gì? Vị trí, đặc điểm, thuộc tính, cấu hình electron
Internet of Things là gì? Thuộc tính và ứng dụng phổ biến nhất
-
Nhức đầu : so2 đi vào cơ thể rồi đi vào máu, ảnh hưởng đến hệ thần kinh khi hít phải. Vì vậy, ngay khi ngửi thấy mùi lưu huỳnh, bạn sẽ bị đau đầu, tùy thuộc vào nồng độ của mùi.
-
Nghẹt mũi : Quá trình đốt cháy lưu huỳnh tạo ra khí sulfur dioxide (so2) và các hạt bụi nhỏ, có thể gây nghẹt mũi khi hít vào và ảnh hưởng trực tiếp đến hô hấp tùy theo tình huống. Nhấn mật độ.
-
Khó thở : So2 vào cơ thể sẽ làm giảm lượng kiềm dự trữ trong máu, dẫn đến rối loạn chuyển hóa đường và protein, thiếu hụt vitamin b và c, máu bị tắc nghẽn. mạch và máu. Điều này có thể khiến dây thanh quản của những người hít phải lưu huỳnh bị thu hẹp, gây khó thở.
-
Viêm phế quản: Khi lưu huỳnh xâm nhập vào cơ thể qua mũi hoặc miệng, nó sẽ hòa tan với các hạt nhỏ trong nước hoặc bụi ẩm và tạo thành các hạt axit sulfuric (h2so4). Sau đó, chúng xâm nhập qua phổi và gây ra các bệnh phổi khác nhau, bao gồm cả viêm phế quản.
-
Ngộ độc máu : Sự xâm nhập của so2 vào cơ thể làm tăng lượng axit và giảm lượng kiềm, do đó gây ra nhiễm độc máu.
-
Tử vong : Khi lượng lưu huỳnh nồng độ cao xâm nhập vào cơ thể, máu bị nhiễm độc, hệ thần kinh bị ảnh hưởng, phổi bị ảnh hưởng…. Điều này có thể làm tê liệt các cơ quan quan trọng, dẫn đến tử vong.
Do đó, con người có thể đối mặt với một số vấn đề sức khỏe nghiêm trọng khi tiếp xúc trực tiếp với lưu huỳnh, bằng cách ngửi hoặc ăn, tùy theo mức độ. Vì vậy, khi tiếp xúc với lưu huỳnh, bạn không nên tiếp xúc trực tiếp. Đối với thực phẩm chứa lưu huỳnh cần rửa kỹ bằng nước trước khi chế biến và sử dụng.
Ảnh hưởng đến sinh vật dưới nước
Các sinh vật và vi sinh vật dưới nước có thể bị ảnh hưởng nghiêm trọng khi nước bị nhiễm lưu huỳnh công nghiệp. Thông thường cá, tôm, cua, ngao, sò… chúng bị ngộ độc lưu huỳnh và chết hàng loạt . Nguy hiểm hơn, con người cũng có nguy cơ cao bị ngộ độc lưu huỳnh gián tiếp khi ăn phải các sinh vật này.
Ảnh hưởng đến môi trường sống
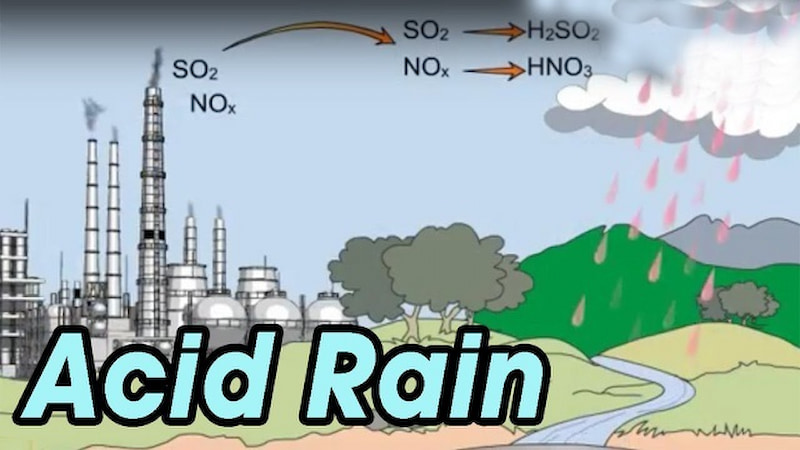
Khi đốt lưu huỳnh ở nhiệt độ cao, môi trường sống bị hủy hoại nghiêm trọng, gây ô nhiễm không khí, biến đổi khí hậu, mưa axit, hiệu ứng nhà kính …
-
Ô nhiễm Môi trường : Lưu huỳnh đioxit là chất gây ô nhiễm môi trường.
-
Mưa axit : so2 bị oxy hóa và khi nó phản ứng với nước tạo thành axit sulfuric, nó tạo ra mưa axit – gây thiệt hại cho các loài thực vật (khi tiếp xúc với môi trường). chứa so2 1-2 ppm trong vài giờ).
-
Phá hủy tầng ôzôn : so2 + o3 → so3 + o2
-
Ô nhiễm nước : Hydro sunfua (h2s), một loại khí được hình thành do sự phân hủy chất hữu cơ, là một trong những nguyên nhân gây ô nhiễm nước và thường được tìm thấy trong nước giếng. Khi nước chứa hàm lượng hydrogen sulfide thấp khoảng 1,0 ppm, nó sẽ bị ăn mòn. Lúc này, nó trở thành axit, ăn mòn kim loại và bê tông, làm thay đổi tính chất vật lý và màu sắc của đá vôi và đá cẩm thạch, phá hủy các công trình kiến trúc, làm gỉ sắt thép, ăn mòn vải, xuất hiện các đốm đen trên giấy …
Những lưu ý khi sử dụng và bảo quản lưu huỳnh
Do tính độc của lưu huỳnh nên khi sử dụng lưu huỳnh cần chú ý những điểm sau để tránh gây hại trực tiếp đến sức khỏe và môi trường sống.
Tôi cần lưu ý điều gì khi sử dụng lưu huỳnh?
-
Đối với các hợp chất chứa lưu huỳnh, bạn cần thận trọng với các hợp chất này (chẳng hạn như carbon disulfide, carbonyl sulfide, hydrogen sulfide và sulfur dioxide).
-
Khi sử dụng thuốc lưu huỳnh, bạn cần chú ý đến liều lượng thuốc lưu huỳnh, thời gian sử dụng, hướng dẫn sử dụng và tuân theo chỉ định chuyên môn của bác sĩ.
Cách bảo quản và bảo quản lưu huỳnh
-
Đối với các hóa chất có chứa lưu huỳnh, bạn cần bảo quản ở nơi khô ráo, thoáng mát tránh ánh nắng trực tiếp.
-
Thuốc có lưu huỳnh cần được bảo quản ở nhiệt độ phòng, tránh ẩm và ánh sáng mặt trời, không bao giờ bảo quản lưu huỳnh trong phòng tắm hoặc tủ đông. Đối với các loại thuốc đã hết hạn sử dụng, không vứt bỏ thuốc có chứa lưu huỳnh trong nhà vệ sinh hoặc đường ống, hãy tham khảo ý kiến dược sĩ hoặc công ty xử lý chất thải địa phương để được tư vấn về những việc cần làm với chúng. Tiêu hủy thuốc an toàn.
Một số hợp chất lưu huỳnh phổ biến
Trong phần này, chúng tôi sẽ giới thiệu một số hợp chất lưu huỳnh phổ biến và các đồng vị của chúng.

Hydrogen Sulfide : Hợp chất chính của lưu huỳnh là hydrogen sulfide, có mùi trứng thối đặc trưng. Khi hòa tan trong nước, hợp chất có tính axit và phản ứng với nhiều kim loại để tạo thành sunfua kim loại. Các sulfua kim loại này rất phổ biến, đặc biệt là sắt (còn được gọi là pyrit).
mercaptan etan và metyl mercaptan : Các hợp chất lưu huỳnh khác, chẳng hạn như etan mercaptan và metyl mercaptan, có mùi khó chịu và được sử dụng làm chất tạo mùi khí để phát hiện rò rỉ.
Nitrua lưu huỳnh polyme hóa : Được tạo ra từ tetranitride lưu huỳnh s4n4 – một hợp chất có tính chất kim loại mặc dù nó không chứa bất kỳ nguyên tử kim loại nào. Chúng có các đặc tính quang và điện khác thường, và polyme có thể được tạo ra từ lưu huỳnh tetranitride, s4n4.
Ngoài ra, một số hợp chất lưu huỳnh quan trọng khác bao gồm:
Một số hợp chất vô cơ :
-
Lưu huỳnh (s2-)
-
Lưu huỳnh (so32-), sunfat, h2so3, axit sunfuric và sunfit tương ứng, ion metabisulfit, metabisulfit (s2o52-).
-
Sunfat (so42-) và sunfat.
-
Thiosulfate (đôi khi được gọi là thiosulfite hoặc “sulfite”) (s2o32-) – là natri thiosulfate.
-
Natri hydrosulfit, na2s2o4 được làm từ sulfoxylat / hythionin.
-
Natri dithionat (na2s2o6)
-
Lithanoate (h2sno6)
-
Axit peroxymonosulfuric (h2so5) và axit peroxydisulfuric (h2s2o8) –
-
Natri polysulfua (na2sx)
-
Lưu huỳnh hexafluoride, sf6
-
Tetrasulfide tetranitride s4n4
Một số hợp chất hữu cơ :
-
Dimethyl sulfopropionat (dmsp; (ch3) 2s + ch2ch2coo-)
-
thiol (hoặc thiol)
-
thiolate
-
Lưu huỳnh
-
Sulfonamide
-
Thuốc thử của Lawson
-
Naphthalene-1,8-diyl 1,3,2,4-dithiodiphosphoric axit 2,4-disulfide
Đồng vị: Lưu huỳnh có tất cả 18 đồng vị, 4 trong số đó là ổn định: s32 (95,02%), s33 (0,75%), s34 (4,21%) và s36 (0,02%)) .
Bài tập và lời giải về lưu huỳnh trong SGK Hóa học 10
Giải bài tập sgk lưu huỳnh lớp 10 chi tiết và dễ hiểu nhất sau đây sẽ giúp các bạn hiểu rõ hơn về lưu huỳnh và những tính chất của nó.
Bài tập 1 trang 132 SGK Ngữ văn 10
Lưu huỳnh phản ứng với axit sunfuric đặc nóng:
s + 2h2so4 → 3so2 + 2h2o
Trong phản ứng này, tỉ lệ giữa số nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hóa là:
A. 1: 2.
b. 1: 3.
c. 3: 1.
d. 2: 1.
Chọn câu trả lời đúng.
Câu trả lời được đề xuất: d là câu trả lời chính xác.
s là chất khử (chất bị oxi hóa) ⇒ số nguyên tử bị oxi hóa bởi s là 1
h2so4 là chất oxi hóa (chất khử) ⇒ số nguyên tử s bị khử là 2
→ Số nguyên tử s bị khử: số nguyên tử s bị oxi hóa là: 2: 1
Bài tập 2 SGK Hóa học 10 Trang 132
Nhóm nguyên tố nào sau đây vừa có tính oxi hoá vừa có tính khử?
A. cl2, o3, s.
b. s, cl2, br2.
c. na, f2, s.
d. br2, o2, ca.
Câu trả lời được đề xuất: b là câu trả lời đúng
Bài tập 3 SGK Trang 132
Làm thế nào để dự đoán sự thay đổi khối lượng riêng và nhiệt độ nóng chảy của lưu huỳnh đơn chất (sb) khi để lâu ở nhiệt độ phòng?
Câu trả lời được đề xuất:
Ở nhiệt độ phòng, có sự chuyển đổi từ sβ → sα, vì vậy khi sβ được giữ ở nhiệt độ phòng trong vài ngày:
-
Khối lượng riêng của lưu huỳnh tăng dần.
-
Nhiệt độ nóng chảy của lưu huỳnh giảm dần.
Bài tập 4 Trang 132 SGK Ngữ văn 10
Đun nóng hỗn hợp gồm 0,650g bột kẽm và 0,224g bột lưu huỳnh trong ống nghiệm kín không có không khí. Sau phản ứng thu được gì trong ống nghiệm? Khối lượng là bao nhiêu?
Câu trả lời được đề xuất:
n (zn) = 0,65 / 65 = 0,01mol
n (s) = 0,224 / 32 = 0,007 mol
-> phản ứng xong, phản ứng zn dư
Phương trình hóa học cho phản ứng
zn + s → zns (nhiệt độ)
nzn phản ứng = 0,007 mol ⇒ nzns = 0,007 mol.
Khối lượng của các chất phản ứng sau:
mzn dư = (0,01 – 0,007) × 65 = 0,195g.
mzns = 0,007 × 97 = 0,679 gam.
Bài tập 5 SGK Hóa học 10 Trang 132
1,10g hỗn hợp bột sắt-nhôm với 1,28g bột lưu huỳnh là vừa đủ.
a) Viết phương trình hóa học cho phản ứng xảy ra.
b) Tính thành phần phần trăm của sắt và nhôm trong hỗn hợp ban đầu theo công thức sau:
-
Chất lượng.
-
Khối lượng của chất.
Câu trả lời được đề xuất:
a) Phương trình hóa học của phản ứng
fe + s → fes
2al + 3s → al2s3
b) gọi nfe = x mol, theo pt ⇒ ns (1) = nfe = x mol
gọi nal = y mol, theo pt ⇒ ns (2) = (3/2). cuối cùng = (3/2). y nốt ruồi
⇒ ns = x + (3/2). y = 0,04 mol.
mhh = 56x + 27y = 1,1.
Giải hệ phương trình, ta có x = 0,01 mol, y = 0,02 mol.
Phần trăm sắt và nhôm trong hỗn hợp (tính theo mol):
% n (fe) = x / (x + y). 100% = 30%
% n (al) = 70%
Phần trăm khối lượng sắt và nhôm trong hỗn hợp:
mal = 0,02 x 27 = 0,54g
mfe = 0,01 x 56 = 0,56 gam.
% mal = (0,54 / 11) × 100% = 49,09%
% mfe = 100% – 49,09% = 50,91%
Vậy lưu huỳnh là gì, lưu huỳnh có độc không và những đặc tính của nó là gì? Chắc qua bài viết trên của khỉ bạn đã có câu trả lời chi tiết và rõ ràng nhất rồi phải không. Hy vọng bài viết này sẽ giúp ích cho bạn trong quá trình học tập của mình. Để biết thêm thông tin về các nguyên tố hóa học thú vị khác, hãy truy cập trang web của khỉ!
-
-
-
-
-
-
-
-
Lưu huỳnh có độc không? Ảnh hưởng xấu của lưu huỳnh đến môi trường và con người
Một người dùng đã tìm kiếm ‘lưu huỳnh có hại’ trên google và nhận được 4.610.000 kết quả trong 0,35 giây. Vậy lưu huỳnh có thực sự độc hại không và tác hại của nó là gì?

Lưu huỳnh có độc không?
Lưu huỳnh là một nguyên tố hóa học độc hại nếu được sử dụng với số lượng lớn. Mặc dù lưu huỳnh điôxít tương đối an toàn với một lượng nhỏ, nhưng với liều lượng đủ cao, nó có thể phản ứng với độ ẩm để tạo thành axit lưu huỳnh, có thể gây tổn thương phổi, mắt hoặc các cơ quan khác.
Tác động tiêu cực của lưu huỳnh
Lưu huỳnh công nghiệp là một hóa chất độc hại và không được phép sử dụng trong chế biến và bảo quản thực phẩm. Tuy nhiên, ở nước ta, do yếu tố lãi suất, việc lạm dụng lưu huỳnh trong công nghiệp rất phổ biến trong bảo quản, sấy khô dược liệu … Nó đã gây ra những ảnh hưởng tiêu cực đến sức khỏe con người, môi trường và các loài sinh vật.
p>
Ảnh hưởng đến sức khỏe con người
Theo khuyến nghị của Tổ chức Y tế Thế giới (tổ chức), hàm lượng so2 trong thực phẩm không được vượt quá 20mg / 1kg. Nhưng ở Việt Nam, việc sử dụng lưu huỳnh cao gấp nhiều lần mức cho phép. Lưu huỳnh không chỉ ảnh hưởng đến cơ thể qua đường tiêu hóa mà còn có thể gây hại cho cơ thể khi ngửi thấy mùi.
Mùi lưu huỳnh quá mức hoặc tiếp xúc trực tiếp với khí lưu huỳnh trong khi đốt có thể gây ra các vấn đề về sức khỏe. Ví dụ:
-
-
-
-
-
-
-



