Glucose có trong hầu hết các bộ phận của con người, thực vật và động vật. Vậy glucose là gì? Hãy cùng chúng tôi tìm hiểu công thức phân tử, cấu tạo, tính chất và chức năng của chất quan trọng này.
Định nghĩa của glucose là gì?
Glucose (còn được gọi là dextrose) là monosaccharide phổ biến nhất với công thức c6h12o6 . Glucose chủ yếu được sản xuất bởi thực vật và hầu hết các loại tảo thông qua nước và carbon dioxide trong quá trình quang hợp, sử dụng năng lượng từ ánh sáng mặt trời. Ở đó, nó được sử dụng để tạo ra cellulose và tinh bột trong thành tế bào.

Trong quá trình chuyển hóa năng lượng, glucose là nguồn nguyên liệu quan trọng nhất cho tất cả các sinh vật để sản xuất năng lượng trong quá trình hô hấp tế bào. Ở thực vật, nó chủ yếu được dự trữ dưới dạng cellulose và tinh bột, ở động vật nó được dự trữ dưới dạng glycogen. (Nguồn: Wikipedia)
-
Công thức phân tử của glucozơ là: c6h12o6
-
Trọng lượng phân tử: 180
-
Đặc điểm cấu trúc: Cấu trúc phân tử của glucose được xác định dựa trên các kết quả thí nghiệm sau:
-
Glucozơ tham gia phản ứng mạ bạc và bị oxi hóa bởi nước brom tạo thành axit gluconic. Điều này cho thấy có một nhóm ch = o trong phân tử glucose.
-
Glucozơ phản ứng với cu (oh) 2 tạo thành dung dịch màu xanh lam, chứng tỏ phân tử glucozơ có nhiều nhóm oh ở các vị trí liền kề.
-
Glucozơ tạo thành một este chứa 5 nhóm axit ch3coo. Do đó, có 5 nhóm oh trong cấu trúc của glucose.
-
Khi khử hoàn toàn glucozơ thu được hexan => 6 c Tạo thành mạch không phân nhánh.
Qua các thí nghiệm trên, chúng tôi kết luận glucozơ là hợp chất có pha tạp chất ở dạng phân tử mạch hở, có công thức cấu tạo là anđehit đơn chức và ancol 5 chức, công thức phân tử: ch2oh – choh – choh – choh – choh – ch = o
.jpg)
Tóm lại: ch2oh (choh) 4cho
Các cacbon được đánh số bắt đầu từ nhóm ch = o.
Trên thực tế, glucose tồn tại chủ yếu ở hai dạng tuần hoàn: alpha-glucose và beta-glucose.
Trạng thái tự nhiên và tính chất vật lý của glucose
Glucozơ xuất hiện ở đâu trong tự nhiên? Hãy cùng xem trạng thái tự nhiên và tính chất vật lý của chất này.
.jpg)
Glucose được tìm thấy trong nhiều loại trái cây tự nhiên, đặc biệt là nho chín. (Ảnh: Sưu tầm Internet)
Trạng thái tự nhiên của glucose
-
Glucose được tìm thấy trong hầu hết các bộ phận của cây, đặc biệt là trong quả chín. Đặc biệt, glucoza có nhiều trong nho chín nên còn được gọi là glucoza.
-
Glucose chiếm 30% trong mật ong .
-
Con người và động vật cũng chứa glucose.
Tính chất vật lý
Glucose là một chất kết tinh không màu, dễ tan trong nước và có vị ngọt nhưng hơi ngọt hơn sucrose.
Tính chất hóa học của glucozơ
Các thí nghiệm sau đây chứng minh rằng glucozơ có những tính chất hóa học duy nhất của rượu đa chức và anđehit.

Tính chất của rượu đa chức
-
Đối với cu (oh) 2
Trong dung dịch, glucozơ hòa tan cu (ồ) 2 ở nhiệt độ phòng, tạo ra dung dịch phức đồng – glucozơ màu xanh lam:
2c6h12o6 + cu (oh) 2 → (c6h11o6) 2cu + 2h2o
-
Esterification
c6h7o (oh) 5 + 5 (ch3co) 2o → c6h7o (oocch3) 5 + 5ch3cooh
=> Phản ứng chỉ ra rằng glucose chứa các gốc tự do 5 oh
Tính chất của Anđehit
Glucozơ tham gia phản ứng mạ bạc, phản ứng khử, lên men rượu …
Phản ứng oxy hóa glucozơ
-
Phản ứng bạc
Dung dịch agno3 có khả năng oxi hóa glucozơ trong môi trường nh3. Các sản phẩm tạo thành là amoni gluconat và bạc. Ta có thể quan sát thấy chúng bám vào thành ống nghiệm.

Phương trình:
ch2oh [choh] 4cho + 2agno3 + 3nh3 + h2o (address: to) → ch2oh [choh] 4coonh4 + 2ag + 2nh4no3
-
Phản ứng cu (ồ) 2 / oh-
Glucozơ bị oxi hóa bởi cu (ồ) 2 trong môi trường kiềm. Phản ứng tạo thành sẽ tạo thành natri gluconat, đồng (i) oxit và nước.
Phương trình:
ch2oh [choh] 4cho + 2cu (oh) 2 + naoh (đơn vị: nhiệt độ) → ch2oh [choh] 4coona + cu2o ↓ (gạch đỏ) + 3h2o
-
Phản ứng với dung dịch brom
Phương trình:
ch2oh [choh] 4cho + br2 + 2h2o → ch2oh [choh] 4cooh + 2hbr
-
Giảm Glucose
Khi cho khí hiđro vào dung dịch glucozơ đun nóng và thêm chất xúc tác niken, ta thu được một polyol gọi là sobitol.
Phương trình:
ch2oh [choh] 4cho + h2 (address: to, ni) → ch2oh [choh] 4ch2oh
Phản ứng lên men rượu
Glucose được lên men để tạo ra etanol và carbon dioxide khi được xúc tác bởi các enzym.
Phương trình:
c6h12o6 (đơn vị: enzyme, 30-35 độ C) → 2c2h5oh + 2co2 ↑
Xem thêm:
- Ethanol (c2h6o): Tính chất, cấu trúc phân tử, ứng dụng và điều chế
- Axit axetic: công thức, tính chất, ứng dụng và bài tập thực hành
-
Công nghiệp: Glucose được điều chế bằng cách thủy phân tinh bột bằng enzym hoặc axit clohydric loãng (hcl). Ngoài ra, người ta còn thủy phân xenlulozơ (có trong dăm bào, mùn cưa) bằng cách xúc tác axit clohiđric đặc thành glucozơ dùng làm nguyên liệu sản xuất etanol.
Phương trình điều chế glucoza:
(c6h10o5) n + nh2o (nhiệt độ, h +) → nc6h12o6
-
Trong tự nhiên: Glucose được tổng hợp trong cây xanh thông qua quá trình quang hợp phức tạp và có thể viết đơn giản dưới dạng phương trình hóa học sau:
6co2 + 12:20 (nắng) → c6h12o6 + 6o2 + 6h20
Vai trò và ứng dụng của gluxit trong sinh hoạt và sản xuất
Glucose lần đầu tiên được phân lập từ nho khô bởi nhà hóa học người Đức Andreas Magraf vào năm 1747. Glucose được Johann Tobias Lowitz phát hiện trong nho vào năm 1792 và được coi là khác với saccharozo (theo Wikipedia). Kể từ đó, các ứng dụng công nghiệp và y tế của glucose đã trở nên đặc biệt quan trọng.
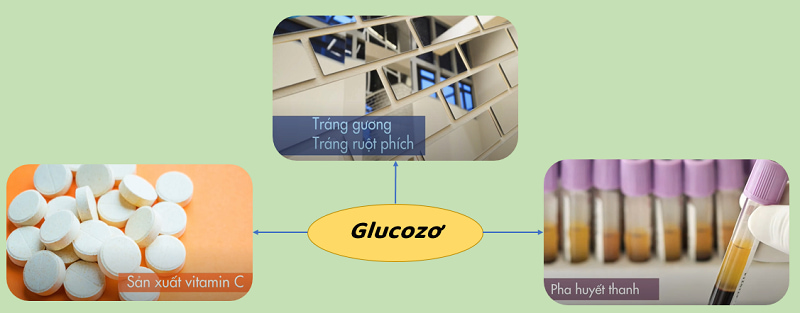
Vai trò của glucose trong công nghiệp
-
Glucose được sử dụng để sản xuất etanol từ tinh bột hoặc nguyên liệu xenlulo.
-
Dextrose được sử dụng làm chất bảo quản trong ngành công nghiệp thực phẩm.
-
Glucose giúp hỗn hợp đường không bị “tái ngọt” – hiện tượng xuất hiện các hạt đường nhỏ khi để lâu. Đồng thời glu còn giúp kẹo không bị khô và giữ được độ mềm lâu.
-
glucozo cũng được sử dụng trong sản xuất kem để giữ cho hỗn hợp nước và đường mịn.
-
Dextrose để tráng gương và tạo hình bằng nhiệt.
Vai trò của glucose trong y học
-
Glucose chứa các chất dinh dưỡng thiết yếu giúp cơ thể tạo năng lượng tốt hơn, vì vậy nó được dùng để làm thuốc tăng lực cho trẻ em, người già và người ốm yếu. p>
-
Glucose cho pha huyết thanh (ứng dụng tiêm truyền trong y tế).
-
Glucose được sử dụng để sản xuất vitamin c.
Vai trò của glucose trong cơ thể con người
-
Glucose là nguồn năng lượng chính và trực tiếp của cơ thể và được lưu trữ trong gan dưới dạng glycogen.
-
là thành phần tham gia vào cấu trúc tế bào (rna và dna) và một số chất đặc biệt khác (như mucopolysaccharide, heparin, hyaluronic acid, chondroitin …). p>
-
Sản xuất năng lượng cần thiết cho sự sống – một quá trình diễn ra trong tế bào. Việc sử dụng glucose của tế bào phụ thuộc vào hoạt động của màng tế bào dưới tác dụng của insulin (trừ tế bào não, mô thần kinh, tế bào máu, tủy thận và thủy tinh thể).
Đồng phân glucoza-fructoza
Bây giờ chúng ta đã học về glucose, hãy tìm hiểu về fructose, một đồng phân của glucose. Trong công thức chung cx (h2o) y, cả hai hợp chất đều có x = 6, y = 6 và cả hai đều là monosaccarit, nhưng điểm khác biệt là gì?

Công thức phân tử: c6h12o6 .
Fructose sẽ có công thức chuỗi mở sau:
ch2oh-choh-choh-choh-co-ch2oh
Trong dung dịch, fructose chủ yếu tồn tại ở dạng beta, vòng 5 hoặc 6-membered.
.jpg)
Không giống như glucoza, fructoza có các tính chất vật lý sau:
-
Fructose là một tinh thể không màu, hòa tan trong nước và ngọt hơn sucrose.
-
Chúng được tìm thấy trong nhiều loại trái cây ngọt và chiếm 40% thành phần của mật ong.
-
Fructozo ngọt hơn sacaroza 1,5 lần và ngọt hơn glucozo 2,5 lần.
Tính chất hóa học của fructose:
Phân tử fructose bao gồm 5 nhóm oh. Có 4 nhóm chức kề nhau và 1 nhóm chức c = o nên có tính chất hóa học của ancol đa chức và xeton. Fructose có tính chất tương tự như glucose.
-
Fructozơ hòa tan cu (ồ) 2 ở nhiệt độ thường.
-
Phản ứng với anhydrit tạo thành este 5 chức.
-
Tính chất của xeton: phản ứng với h2 tạo thành sobitol và tham gia phản ứng cộng hcn
-
Trong môi trường trung tính hoặc axit, fructozơ không thể hiện tính khử của anđehit, nhưng trong môi trường kiềm, fructozơ lại có tính chất này do có sự chuyển hóa giữa glucozơ và fructozơ qua trung gian là một enđiol.
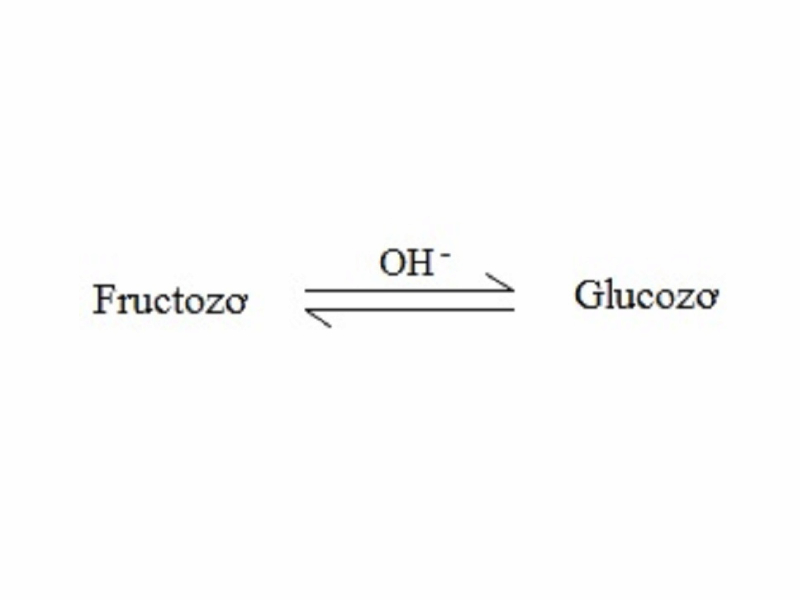
Lưu ý: Trong môi trường kiềm, fructozơ chuyển hóa thành glucozơ nên fructozơ có phản ứng tráng gương và phản ứng với cu (ồ) 2 trong môi trường kiềm. Nhưng fructozơ không có phản ứng khử màu dung dịch brom. Đây là dấu hiệu nhận biết đường fructose và glucose.
Bài tập và lời giải về glucozơ trong SGK Hóa học 9
Từ những kiến thức đã học về glucozơ ở trên, các em có thể vận dụng kiến thức này để giải một số bài tập cơ bản trong SGK Hóa học 9 dưới đây.

Giải bài 1 Trang 152 SGK ngữ văn 9
Kể tên một số loại quả chín có chứa glucozơ.
Câu trả lời được đề xuất:
Glucozơ có trong một số loại quả chín như: nho chín, chuối chín, ổi chín, mít chín, ổi chín, dứa chín (thơm).
Giải bài 2 SGK Hóa học 9 Trang 152
Chọn một thuốc thử để phân biệt hóa học các dung dịch sau. (nêu rõ cách thức tiến hành).
a) Dung dịch glucozơ và dung dịch etanol.
b) Dung dịch glucozơ và dung dịch axit axetic.
Câu trả lời được đề xuất:
a) Lấy mẫu thử nghiệm và đánh số thứ tự:
Chọn thuốc thử là agno3 (đun nóng) trong dung dịch nh3: nhỏ lần lượt vài giọt agno3 trong dung dịch nh3 vào 2 ống nghiệm, sau đó cho các ống nghiệm vào cốc đựng nước nóng:
Chất nào tham gia phản ứng tạo sản phẩm sáng bạc bám vào thành ống nghiệm, đó là glucozơ
pthh: c6h12o6 + ag2o -> c6h12o7 + 2ag (xúc tác: nh3)
Một chất khác không hoạt động là etanol.
b) Lấy mẫu thử nghiệm và đánh số thứ tự:
Chọn thuốc thử là na2co3: nhỏ vài giọt dung dịch na2co3 vào 2 ống nghiệm
Phản ứng ống nghiệm nào giải phóng khí là ch3cooh
pthh: 2ch3cooh + na2co3 → 2ch3coona + h2o + co2
Những gì còn lại chưa phản ứng là glucose
(Có thể dùng thuốc thử quỳ đỏ, dung dịch làm quỳ tím chuyển sang đỏ là ch3cooh, còn một chất khác không làm đổi màu quỳ đỏ là glucozơ).
Giải bài 3 SGK Sinh 9 trang 152
Tính khối lượng glucozơ cần dùng để pha 500 ml dung dịch glucozơ 5% có d = 1,0 g / cm3.
Câu trả lời được đề xuất:
mdd glucose = 500. 1 = 500 (g)
Glucose = (500,5) / 100 = 25 (g)
Giải bài 4 Trang 152 SGK ngữ văn 9
Khi lên men glucozơ, ở điều kiện tiêu chuẩn thoát ra 11,2 lít khí cacbonic.
a) Tính khối lượng etanol tạo ra sau khi lên men.
b) Biết hiệu suất của quá trình lên men là 90%, tính khối lượng glucozơ đã ăn vào lúc đầu.
Câu trả lời được đề xuất:
a) Chất lượng Ethanol:
n (co2) = 11,2 / 22,4 = 0,5 mol
Phương trình lên men glucose:
c6h12o6 → 2c2h5oh + 2co2.
Theo phương trình: n (etanol) = nco2 = 0,5 mol.
m (etanol) = 0,5 × 46 = 23 gam.
b) Khối lượng glucozơ.
Theo phương trình glucozơ = 1/2. nco2 = 1/2. 0,5 = 0,25 mol
Vì hiệu suất là 90% nên lượng glucozơ cần dùng là:
0,25 x 180 x 100/90 = 50g
Bài viết trên cung cấp đầy đủ thông tin về công thức, cấu tạo, tính chất và tác dụng của tá dược glucozo – một chất rất phổ biến xung quanh chúng ta. . Chia sẻ bài viết và truy cập trang web con khỉ để biết thêm kiến thức hữu ích về toán, lý, hóa và hơn thế nữa!
-
-
-
-
-
-
Cách điều chế glucose
Trong công nghiệp và trong tự nhiên, các phương pháp sản xuất glucozơ là khác nhau. Vì vậy, chất lượng và giá cả là hai yếu tố mà chúng ta cần quan tâm trong quá trình sử dụng.

-
-
-
-
-
-
-
-



